

免疫组化技术由于具有特异性强、敏感性高、定位准确的特点,对于疾病的诊断与鉴别诊断有着重要意义,当免疫组化结果没有出现预期的效果时,应系统的分析和查找原因,找到有效的解决办法。
IHC实验步骤繁琐,包括切片制作(固定,脱水,透明,包埋,切片,贴片,烤片),脱蜡,水化,阻断,抗原修复,封闭,一抗孵育,二抗孵育,显色,复染,封片和分析等,在上次的推文中向您介绍了切片制作和抗原修复两个步骤中的常见问题及解析,本次为您带来的是封闭和一抗孵育中的注意事项。文末还附有IHC通关的秘密武器——Bioss全新上市的IHC即用型试剂盒,助您一次获得文献级的图像结果。
封闭
1.图片背景值过高。
解决方法:①在使用抗体前采用溶于甲醇或水的3% H2O2或使用专门的试剂盒进行淬灭,并使用碱性磷酸酶抑制剂,以减少内源性过氧化物酶或磷酸酶的干扰;
②使用生物素类的二抗系统来检测如肾脏和肝脏等富含生物素的组织样本时,可以在一抗孵育前用亲和素/生物素封闭试剂进行封闭,以减少内源性生物素活性的干扰;
③在加入抗体前把多余的缓冲液吸干,而非对组织样品进行洗涤,以减少来自内源性酶的干扰;
④蛋白封闭时间不足导致背景增强甚至出现假阳性,应选择合适的封闭液,适当延长封闭时间;
⑤所用血清溶血,应选择合适的封闭液。
2.染色结果呈假阴性。解决方法:①封闭时间过长导致阳性信号减弱甚至出现假阴性,应选择合适的封闭液,适当减少封闭时间;②血清封闭液和一抗来源种属相同,血清中的抗体可能和目的蛋白特异性结合了,进而导致一抗没有结合位点,产生假阴性。
3.目标蛋白定位异常。解决方法:①热灭活正常血清或BSA对组织进行封闭孵育。
一抗孵育
1.图片背景值过高。
解决方法:①抗体孵育后洗涤不充分,残留抗体导致背景染色,建议增加抗体孵育后的浸洗次数,延长浸洗时间。
2.染色结果过强。解决方法:①一抗浓度过高是常见原因之一,可适当调整抗体稀释比;②一抗孵育温度高,时间长,一般建议4℃过夜孵育,低温虽然会使抗体结合缓慢,但特异性结合更好。
3.阳性检测率及着色强度相对减弱,甚至无染色。解决方法:①抗体效价不高。可通过增加抗体使用浓度,延长抗体孵育时间进行调整;②所用抗体不适用于IHC实验。建议在非变性WB上测试该抗体,以确保抗体识别非变性抗原,或是选用通过IHC实验验证的抗体;③一抗二抗不匹配。使用针对一抗物种来源的二抗,如一抗宿主为rabbit,则须使用anti-rabbit的二抗;④抗体失活。避免将标记荧光基团的二抗放置于光照环境;⑤靶蛋白为核蛋白而抗体不能穿透细胞核时,建议在封闭溶液与抗体稀释液中加入合适的渗透试剂,例如Triton X-100,以促进抗体渗透到细胞内。
4.染色结果呈弱阳性。解决方法:①适当调整抗体稀释比,或者选择染色强度高,高亲和力的抗体;②设置阳性组织切片的对照,因为同一蛋白在不同组织中的表达会有很大的差异;③切片在染色过程中抗体过浓或干燥了。切片上遗留了过多的冲洗液,当抗体加至切片上时;等于人为地对抗体进行了进一步的稀释,滴加试剂前应尽量减少残余液体。
5.染色结果出现非特异性染色。解决方法:①可以通过调整抗体的稀释比进行改善,特异性强的抗体则不易受稀释比的影响;②一抗浓度太高,在使用新抗体前可以通过预实验摸索出最理想的工作浓度,不能简单地按照说明书来用;③孵育时间过长或孵育温度过高,建议摸索不同抗体的最佳孵育条件;④一抗非特异性结合过高,可通过降低一抗浓度或缩短孵育时间进行改善;⑤一抗与实验组织同源,加入二抗后,二抗与组织结合。应换与组织非同源的一抗;⑥一抗为多抗,建议更换为单克隆抗体;⑦抗体稀释液中添加非离子型去污剂包括Triton X-100或Tween 20减少非特异性疏水相互作用。
新品上市
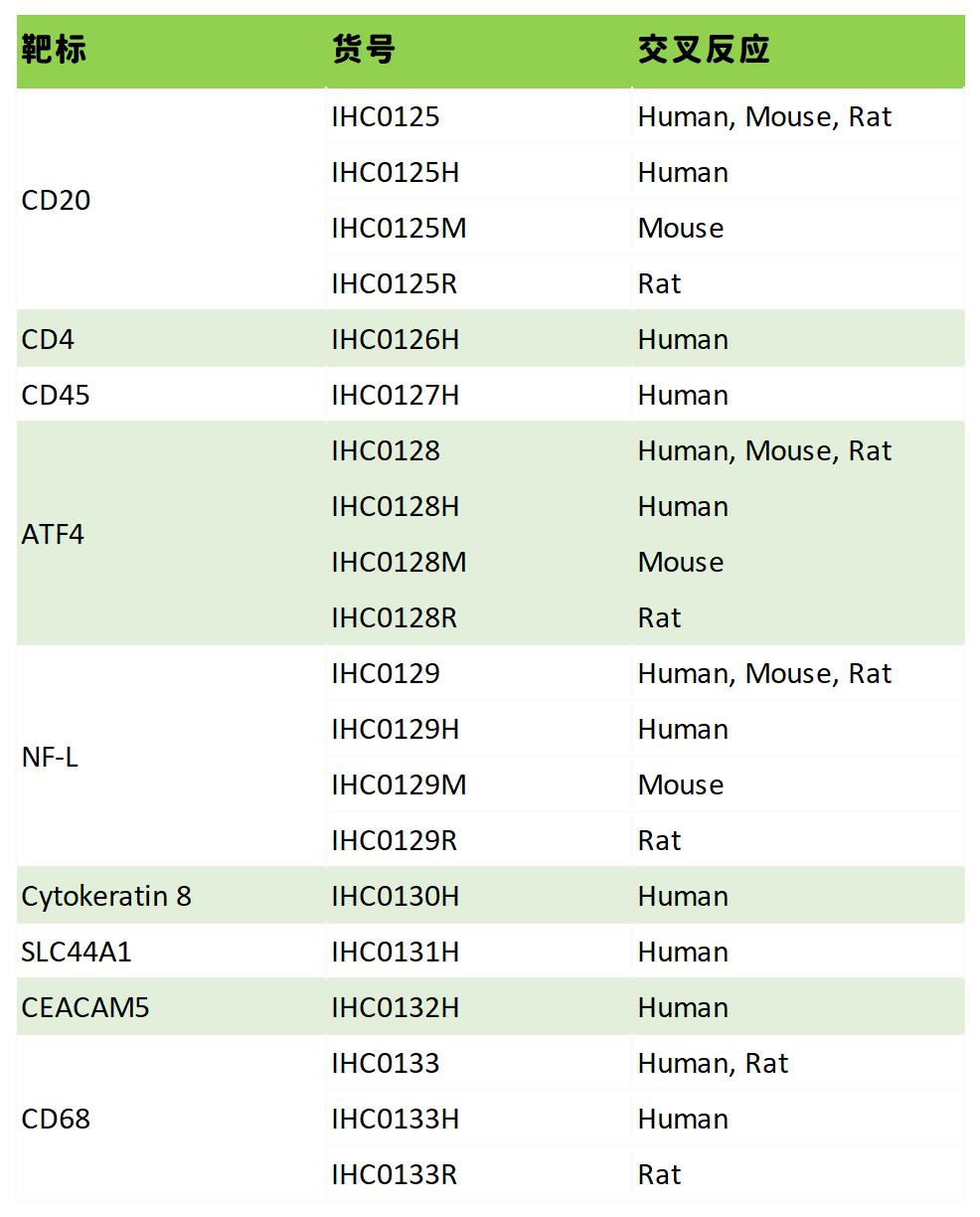
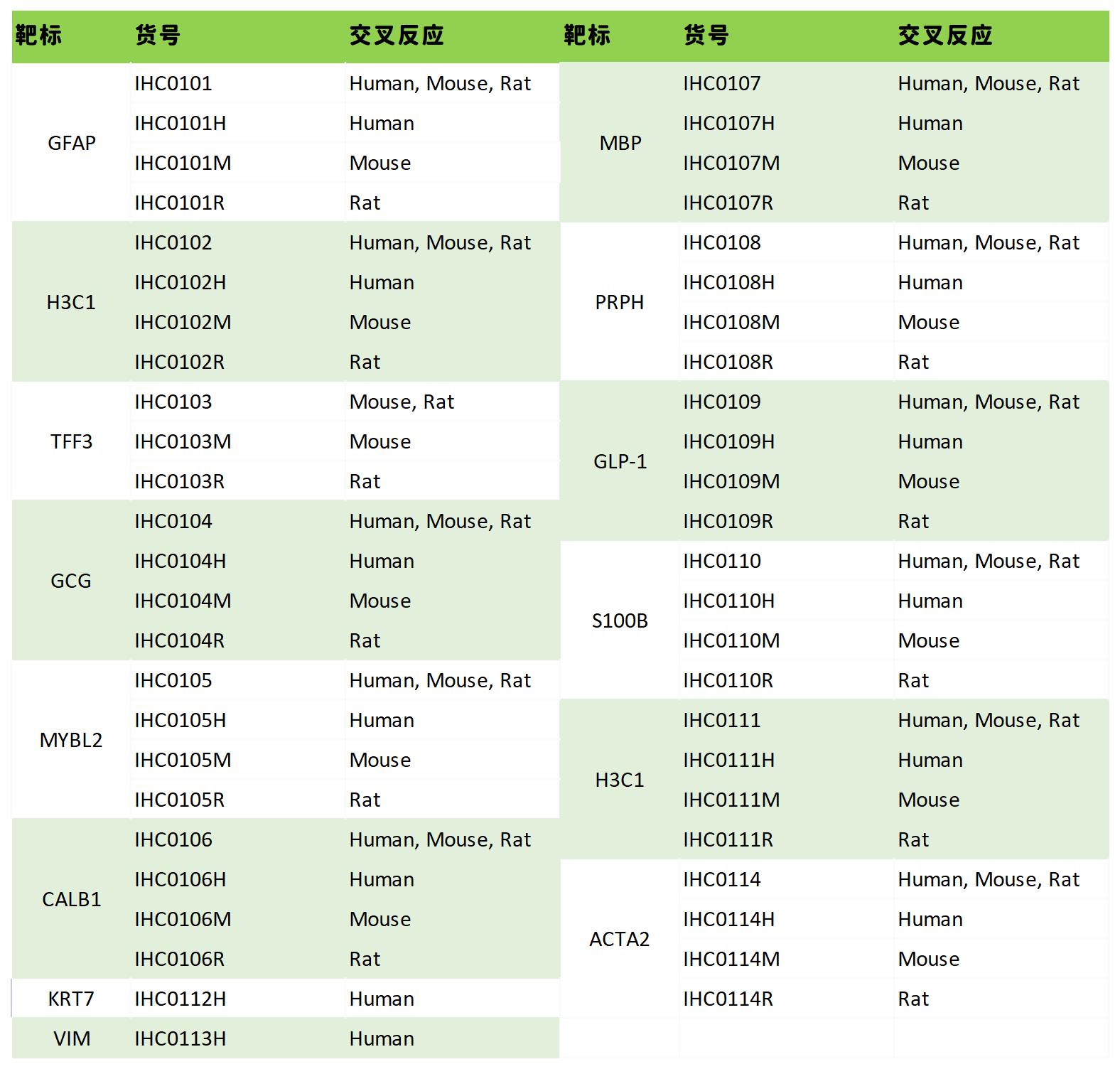
热销产品
受篇幅限制,本次IHC实验过程中的常见问题解析就先分享到这里。如果您还想更深入的学习IHC相关问题,可以继续关注本系列后续文章。如果您在使用我们的产品时出现任何问题,请随时联系我们,Bioss资深IHC实验专家将为您全面讲解,深度分析,帮助您轻松解决IHC的“疑难杂症”!