
文章信息
期刊:Advanced Functional Materials
影响因子(IF):15.621
文章名称:Enhancing Triple Negative Breast Cancer Immunotherapy by ICG-Templated Self-Assembly of Paclitaxel Nanoparticles(点击获取全文)
作者:冯兵
作者单位:中国科学院大学&中科院上海药物研究所
引用抗体:anti-Calprotectin(CRT)|bs-2696R
anti-high mobility group B1 (HMGB-1)|bs-0664R
肿瘤联合免疫治疗在诱导抗肿瘤免疫和调节免疫抑制性肿瘤微环境(ITM)方面均显示出良好的潜力。然而免疫联合疗法的化学物理性质不同,药代动力学特征不一致。吲哚菁绿(ICG)模板自组装置——一种用于制备双药合一的纳米药物,实现了免疫调节剂的肿瘤特异性共传递。通过ICG模板的紫杉醇(PTX)纳米颗粒自组装(ISPN),以及ISPN在三阴性乳腺癌(TNBC)联合免疫治疗中的应用进行了论证。ISPN通过增强肿瘤的通透性和滞留效应,对ICG和PTX的肿瘤特异性共递送表现出满意的胶体稳定性和高效性。激光照射后,ISPN的ICG组分通过光动力疗法激活抗肿瘤免疫反应,高效诱导肿瘤细胞免疫原性死亡。同时,ISPN抑制调节性T淋巴细胞(Tregs)对抗ITM,释放PTX。ISPN与免疫检查点阻断治疗(αPD-L1)结合使用治疗TNBC,显示出协同的肿瘤退缩、转移抑制和预防复发作用。总的来说ICG模板的纳米药物在开发纳米药物平台和联合免疫疗法应用方面具有巨大潜力。
研究背景
三阴性乳腺癌(TNBC)是最具高浸润性和转移性的恶性肿瘤之一。化学疗法是AD临床治疗晚期或转移性TNBC肿瘤的主要方法。然而,由于固有或获得的多重耐药性的发生,化学疗法疗效低下的局限性凸显。前几年免疫治疗,特别是免疫检查点阻断治疗(ICB)开启了癌症治疗的新篇章。尽管前景看好,但由于TNBC肿瘤的免疫原性低和免疫抑制性肿瘤微环境(ITM),TNBC患者很少受益于当前的ICB治疗。因此,在改善TNBC免疫治疗方面,找到能增强免疫原性并逆转ITM的互补方法仍然是一个巨大的挑战。ICB疗法与化学疗法、光动力疗法(PDT)或放射疗法相结合,具有协同抗肿瘤作用,可促进肿瘤内细胞毒性T淋巴细胞(CTLs)的浸润并克服ITM。然而,联合免疫疗法使用不同的免疫调节剂,其化学物理特性和药代动力学特征不同。尽管基于纳米颗粒的药物递送系统有望实现联合免疫疗法,但目前的纳米药物的制备方案通常过于复杂,无法实现可重复性和质量控制。此外,辅料对于制备载药纳米颗粒是必不可少的,辅料的使用会导致载药量降低。近年来,无辅料的纳米药物在高效药物输送方面引起了广泛关注。当前大多数无辅料的纳米药物已被设计为可自行组装成纳米制剂的前药结构。小分子疗法的化学修饰对于开发常规的无辅料纳米粒子至关重要,但这可能会削弱抗癌药的治疗性能。鉴于此,作者利用吲哚菁绿(ICG)为模板进行自组装制备二药合一的纳米药物并用于联合免疫疗法。该策略可不使用任何辅料而实现几乎100%的各种小分子药物的负载(图1a)。为了进行概念验证,作者专注于开发用于TNBC联合免疫治疗ICG模板自组装紫杉醇(PTX)纳米颗粒(ISPN)(图1b)。ICG可以进行光动力学疗法(PDT)诱导肿瘤细胞的免疫原性细胞死亡(ICD)。ICD的肿瘤细胞将钙网蛋白(CRT)暴露在细胞膜表面,释放高迁移率族蛋白B1(HMGB1),并分泌三磷酸腺苷(ATP)启动抗肿瘤免疫应答。同时,与ISPN共传递的PTX通过特异性杀伤调节性T细胞(Tregs)来对抗ITM。PTX是临床治疗TNBC的一线化疗药物之一,它可以稳定化微管蛋白并抑制肿瘤细胞有丝分裂抑制肿瘤生长。相较于PTX的化学细胞毒性,一些临床前和临床研究表明PTX通过调节免疫抑制肿瘤微环境增强了ICB治疗的疗效。例如,低剂量的PTX(5mg/kg)通过下调Tregs有效地逆转了ITM。PTX降低Tregs瘤内浸润,并使细胞死亡受体Fas(又称CD95)上调以此来抑制Tregs的免疫抑制功能。ISPN与免疫检查点阻断剂(即抗PD-L1抗体,αPD-L1)结合使用,在具有TNBC肿瘤免疫能力的荷瘤小鼠模型中显示出协同的抗肿瘤性能(图1c)。综上所述,ICG模板自组装纳米医学可能是TNBC免疫治疗的有力策略。

图1.用于TNBC肿瘤免疫治疗的PTX纳米颗粒ICG模板自组装的示意图。(a)可供ICG模板化自组装的小分子药物库;(b)PTX纳米颗粒的ICG模板自组装;(c)ISPN介导的癌症免疫治疗示意图。ISPN联合免疫治疗联合ICB诱导肿瘤细胞ICD,并消除免疫抑制Tregs。
研究结果之一ISPN的ICD诱导作用
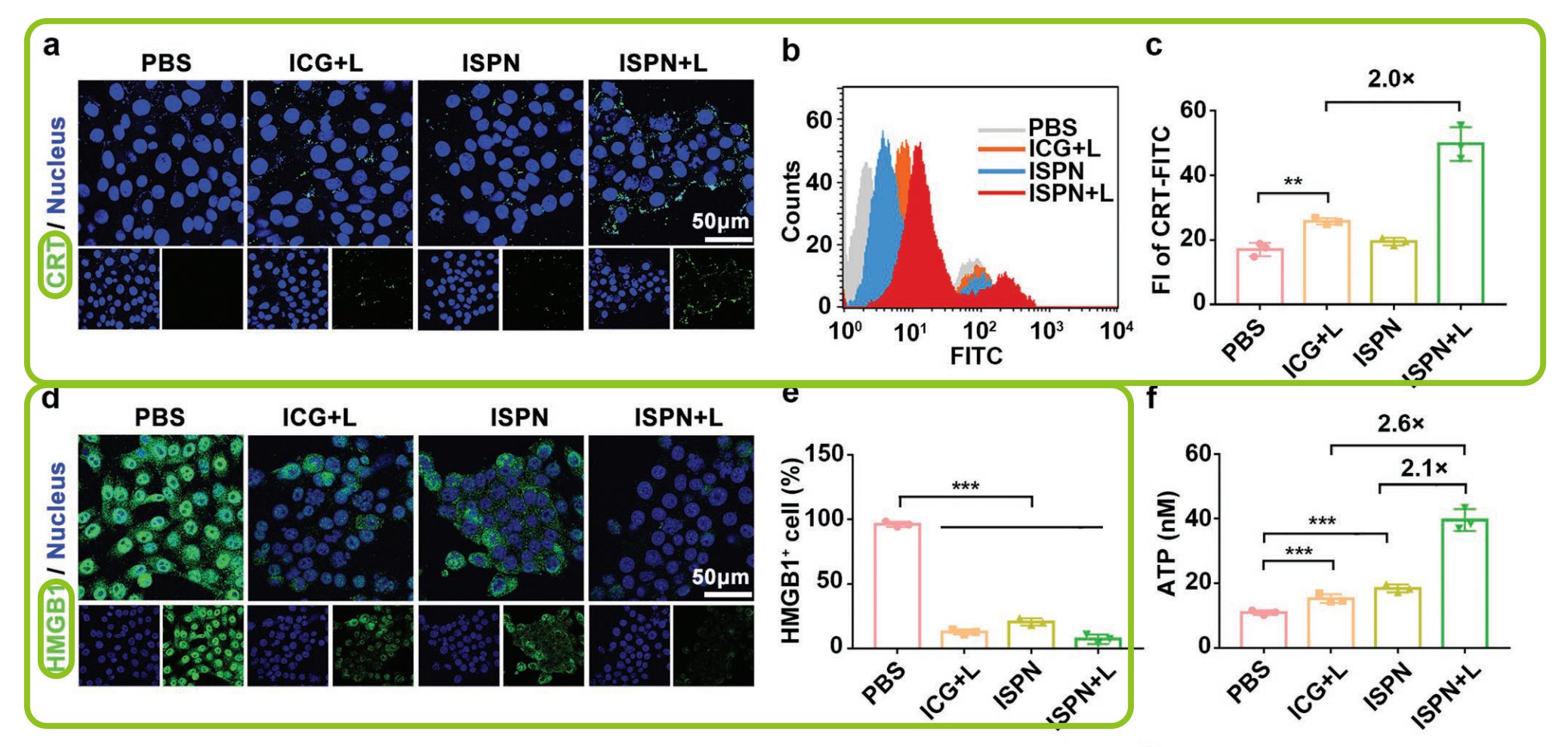
CRT是ICD的主要生物标志物,充当“吃我”信号,以诱导抗原呈递细胞吞噬垂死的肿瘤细胞。由细胞内ROS产生引起的内质网应激可触发CRT表达并将其转运到肿瘤细胞表面。为了研究ISPN在体外的ICD诱导特性,4T1肿瘤细胞在含1ug/ml ICG 的ISPN中孵育8h后,808nm激光照射30s。2小时后CLSM及FC检测细胞表面ICR表达。ICG+L及ISPN均可诱导4TI细胞表面CRT的上调表达(图2a),而FCM检测结果显示ISPN + L显著引起4T1细胞表面CRT表达。ISPN+L组CRT表达是ICG+L组的2倍(图2b,c),这可能归因于ISPN + L大量产生细胞ROS。接下来,作者通过检测治疗诱导的蛋白HMGB1的转运。HMGB1通常分布在细胞核,在ICD的肿瘤细胞迁移到细胞外。胞外HMGB1可作为Toll样蛋白受体激动剂促进DC成熟。CLSM结果显示HMGB1全部转运至细胞外(图2d)。FCM结果进一步表明ISPN处理的4T1细胞中HMGB1下降,而激光照射后的4T1细胞中HMGB1进一步降低(图2e)。为了证实ISPN的ICD诱导性能,ATP化验检测ATP分泌。ATP检测结果显示ISPN+L组分别是ICG+L和ISPN组的2.6倍和2.1倍(图2f)。ISPN表明ISPN能有效地诱导肿瘤细胞的ICD。紧接着作者体外检测ISPN诱导肿瘤细胞免疫原性对DC成熟的影响,以此评价ISPN诱导肿瘤细胞的免疫原性。FCM检测显示ISPN+L显著提高DC成熟(图2g)。ISPN组的DC成熟频率约为18.6%,而进行了激光放射处理的肿瘤细胞中提高到了50.1%左右(图2h)。这些结果表明ISPN可有效诱导肿瘤细胞ICD并增强了肿瘤免疫原性以促进DC成熟。体外检测4T1细胞的ISPN细胞毒性,基于ICG的PDT治疗和PTX的化学治疗可引起部分的肿瘤细胞死亡。相比之下,ISPN和激光放射治疗联合可大大降低细胞的存活能力。ISPN介导的化学疗法和PDT在体外具有累积的抗肿瘤作用。

图2.体外ISPN的ICD诱导作用。(a)CLSM和(b)FCM检测在ISPN处理及激光放射后4T1肿瘤细胞表面CRT分布;(c)FCM检测4T1细胞表面CRT表达;(d)CLSM和(e)FCM检测ISPN处理的41T细胞中HMGB1的释放;(f)ISPN处理的4T1细胞ATP分泌;(g)ISPN处理的4T1细胞诱导BMDC成熟的FCM图(设门CD11c+);(h)FCM检测BMDC成熟率;(i)4T1细胞体外细胞毒性试验(标尺=50μm,*p<0.05;**p<0.01;***p<0.001)。
在本研究中,作者证明了小分子药物的ICG模板自组装纳米颗粒的制备。相较于游离ICG和PTX,整合ICG和PTX的ISPN在荷瘤小鼠的体外血液循环拉长,肿瘤积累提高。在肿瘤细胞的体外和体内检测,ISPN通过PDT诱导的ICD有效地诱导抗肿瘤免疫并促进CTLs的瘤内浸润。同时,ISPN极大地抑制了Tregs的招募,从而解除ITM。综上所述,通过制备ICG模板的小分子药物自组装纳米颗粒,结合ICB治疗显示出累积的抗肿瘤性能,可抑制肿瘤生长并抑制肺转移,同时能防止肿瘤复发。最重要的是ICG模板自组装容易扩展到其他小分子药物。本研究展示了ICG模板自组装策略在开发无辅料纳米药物和联合免疫疗法方面的潜力。
(感谢《Advanced Functional Materials》提供素材!侵删!)Bioss相关抗体推荐