抗体是生物学科研工作中最有力的工具,没有之一。这些“精确制导武器”,会在研究中主动寻找并结合研究者感兴趣的目标,并可通过各种示踪技术将目标展现出来。正是由于抗体的专一特性,研究者可能会依赖于示踪实验所显示的结果对所研靶标给出定性或定量的判断。也正因此,毫无疑问的,专一性或特异性是抗体最受科研工作者关注的特性。那么,抗体特异性主要由什么决定?为什么常听到多抗特异性不如单抗的说法?在实验中,是该选择单抗还是多抗?
下面我们将就抗体的生产制备过程分析抗体特异性差异的原因。
抗体的制备,无论是单抗还是多抗,其前期的动物免疫步骤是完全相同的,差异仅仅在筛选。或者说,单抗是在多抗制备的基础上,进一步筛选并稳定表达特异单克隆细胞株的结果。当抗原免疫动物后,在淋巴结和脾等淋巴器官内通过一系列抗原处理和递呈,促使B淋巴浆母细胞(Plasmablasts, PBs)分化成熟,在转录水平成为分泌特异抗体的B淋巴浆细胞(Plasma cells, PCs),大量不同的浆细胞会分泌不同的针对抗原的抗体。由此,可以说每一个B浆细胞都成为一株单克隆抗体的候选者。
传统的单克隆抗体制备就是通过将小鼠脾细胞与骨髓瘤细胞系融合,筛选能够分泌特异抗体并稳定传代的融合细胞株而实现的。而多克隆抗体(多抗)的制备就是从血清中分离纯化所有的未经筛选的单克隆抗体。从以上过程可以看出,无论是单抗还是多抗制备方法,其针对靶点(抗原)的特异性抗体的产生主要源于被免疫动物自身的浆细胞分化成熟,抗体生产者(人)其实并没有做什么。
不同在于,多克隆抗体犹如许多单克隆抗体的集合,它们有的特异性高,有的特异性低,总体特异性符合正态分布曲线的形式(如Fig1),而其特异性的总体表现也应处于统计学正态曲线中位线(MID)的水平。而单抗制备后续的筛选过程,可去除大部分的非特异抗体,保留几株特异性较好的单克隆抗体。
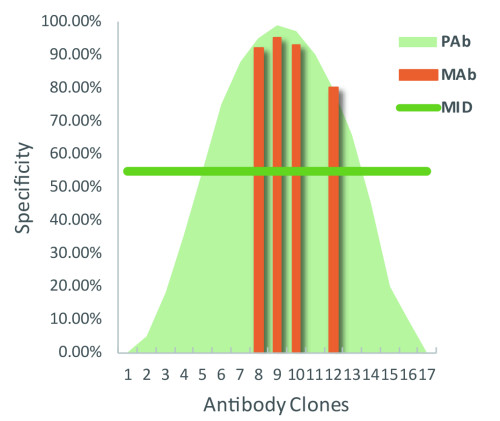
Fig1.单抗与多抗特异性示意图
然而,单抗制备过程中的细胞融合是一个随机发生的过程,动物脾脏内的各种细胞如内皮、平滑肌、巨噬、NK、T、还有红细胞、血小板等都可能与骨髓瘤细胞系发生融合。尽管B细胞是脾脏内主要的淋巴细胞,但能够分泌特异性抗体的成熟浆细胞占脾细胞的比例很低,加之促细胞融合试剂如PEG等的细胞毒性,使得最终成功融合形成稳定表达特异性抗体的杂交瘤细胞系的效率极低,大约为10-6。因此,在单抗制备过程中,大部分分泌特异性抗体的B细胞可能都被损失了。最终获得的单克隆抗体其亲和力和特异性可能都不是本次免疫中最好的。
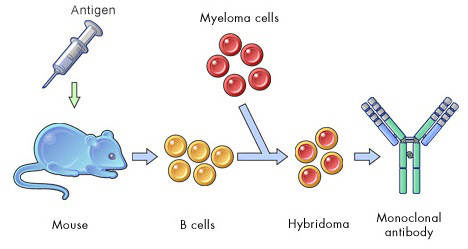
Fig2. 单克隆抗体制备流程
假如把每个浆细胞比作一个士兵,人就是指挥官,指令新兵们训练打靶。打靶的次数(免疫次数)增多后,会有越来越多的新兵变成神枪手。指挥官将好的神枪手挑出来,培养成一个一个的“狙击手”(单克隆抗体)。然而,狙击手的选拔机制却是简单粗暴的,且与狙击能力无关,比如能否举起200 kg的杠铃,这可能将真正优秀的狙击手淘汰掉了。而多抗就像一个经过训练的老兵连队,既有枪法平庸的兵,同时也拥有优秀的狙击手。
生物样本的成分通常非常复杂。杂带或高背景通常是由于多克隆抗体中有的抗体克隆非特异地结合复杂样本造成的。如前所述,多抗所表现的特异性是多个抗体克隆的中位线水平。所以从特异性上讲,多抗通常不如单抗。多抗特异性可通过生产环节比如使用高纯度的免疫原,以及使用提纯的靶点蛋白对多抗进行免疫亲和层析纯化等方法得以改进。经过免疫亲和层析的多抗其总体特异性将大大提升,与单抗相比已相差无几。
另一方面,不同生产厂商制备多抗的原理方法基本相同,然而在抗原设计及制备上千差万别。如使用全长蛋白,则蛋白的表达纯化,如使用多肽,则多肽的位置选择,不同厂商都有各自的策略,这也使得针对同一靶点的多抗特异性相差较大。在研究者的交流过程中也留下“多抗特异性差”的印象。因而,如果使用多抗检测,推荐更有经验、口碑更好的生产厂商。
一般而言,单克隆抗体的确具有更高的特异性,但这个特异性是指针对抗原上一个表位(epitope)或抗原决定簇(determinant)的特异性,而不是指针对整个靶点蛋白的特异性。根据抗体最核心的表位结合区域—互补决定区(Complementarity Determining Region,CDR)的结构,抗体通常可以紧密结合的抗原表面区域或表位面积很小(<5 nm),对于变性的肽段约在4-8个Aa以内,以及5-7个单糖的糖链或6-8个核苷酸的核酸。通过肽段BLAST可以得知,小肽段序列完全相同的情况将在很多不同蛋白上发生。这意味着单抗识别的这个表位可能并不仅仅属于靶标蛋白本身,也即意味着,即使利用纯化抗原蛋白进行了特异性筛选的单克隆抗体,当用其检测复杂样本时,也将面临交叉反应或假阳性问题。这仍须以不同的检测手段比如基因敲除等对结果进一步确认。
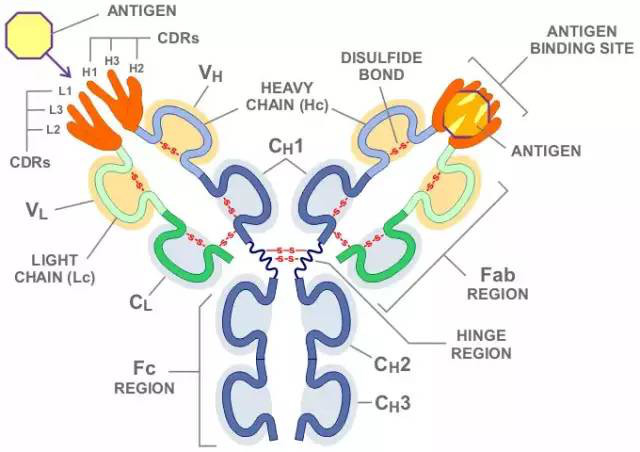
Fig3. IgG分子结构
当我们计划利用抗体去抓出感兴趣的靶点时,需要考虑抗体的特异性和敏感性两个因素。特异性决定了假阳性结果的多少,敏感性决定了检出率的高低。在复杂样本中,由于多克隆抗体识别抗原的多个表位,可以在一个抗原分子上结合更多的抗体分子,也可以在当部分抗原表位受到一定程度的遮盖或破坏时,仍有抗体结合在未受影响的表位上。这种情况常发生在如石蜡包埋的免疫组化(IHC-P)等实验中,当样本经甲醛交联固定后,即使经过抗原修复,抗原表位也不可避免地受到了影响,此时单克隆抗体由于只识别一个表位,结合能力可能大大降低甚至呈现阴性结果,而只要不是所有表位都受到了破坏,多抗仍可以获得该靶点的阳性结果。同样的,对于样本中一些表达丰度极低的蛋白,由于多表位结合更多抗体分子,检测信号就将被放大,因此,使用多抗具有灵敏度和检出率上的优势。
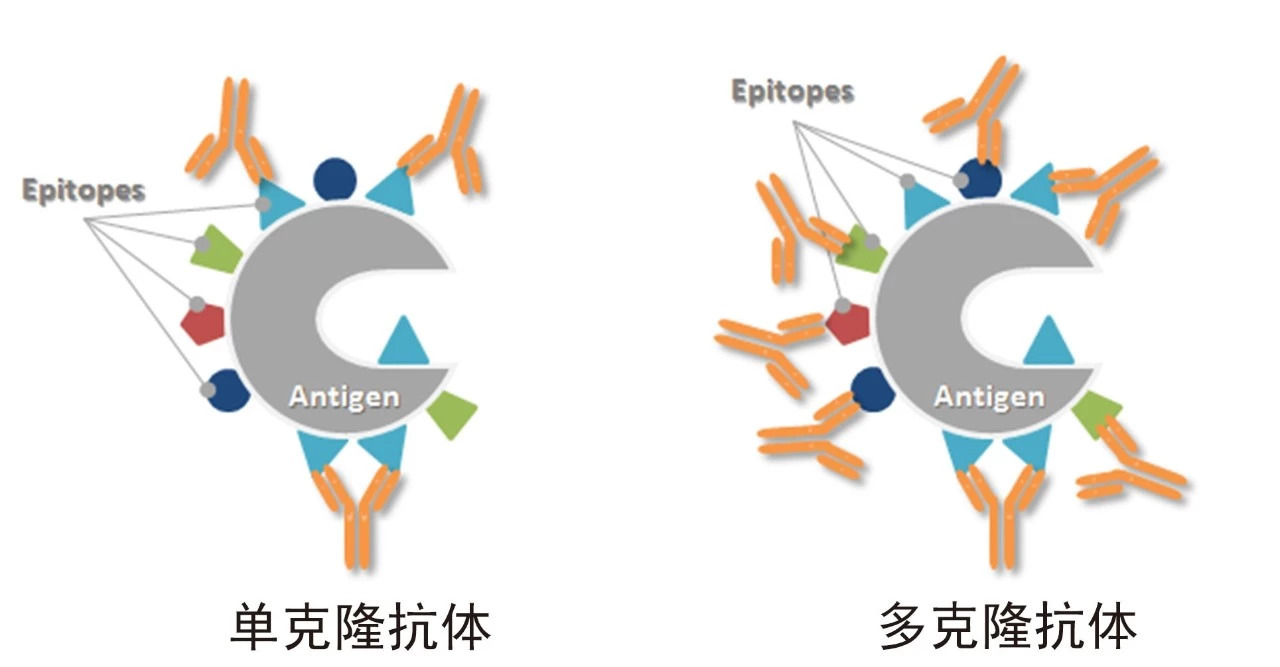
小结
单克隆与多克隆抗体差异总结
|
|
单克隆抗体 |
多克隆抗体 |
|
制备周期 |
长(5-6个月) |
短(2-3个月) |
|
技术要求 |
高 |
低 |
|
产量 |
高 |
低 |
|
价格 |
高 |
低 |
|
对免疫原要求 |
较高 |
高 |
|
特异性 |
高 |
高(抗原亲和纯化) |
|
识别表位 |
一个 |
多个 |
|
非特异结合 |
较少 |
较多 |
|
灵敏度 |
较高 |
高 |
|
标准化 |
易,批间差小 |
较难,批间差大 |
|
稳定性 |
较好 |
好 |
|
凝集反应 |
大多数没有 |
有 |
|
沉淀反应 |
大多数没有 |
有 |
|
中和活性 |
大多数没有 |
有 |
为减少多克隆抗体制备中的批间差,生产环节需要更加严格控制,每批次免疫动物的数量至少三只,以降低动物个体差异影响。动物的来源、种系、性别、周龄、体重、饲喂环境、免疫原及免疫流程(SOP)等也严格保持一致,这样可以有效控制多抗生产时的批间差。
总之,在不同实验中善用“狙击手”和“老兵连队”,可以更加高效地获得所需的实验结果。