流式细胞术Flowcytometry
原理:流式细胞术(flowcytometry FCM)是对单个细胞或其他生物微粒进行快速定量分析和分选的一门技术。在分析或分选过程中,包绕在流动液体中处理过的单个细胞或微粒通过聚焦的光源,产生电信号,这些信号代表光散射、荧光等参数,以此测定出细胞或微粒的物理和化学性质,并可根据这些性质分选出高纯度的细胞亚群,以对其进一步的培养或分析。
应用:流式细胞术的功能决定了其在免疫学基础研究中的广泛应用,目前在临床上主要用于细胞表型分析、造血系肿瘤诊断和分型、移植前配型及与免疫有关疾病分析等。
(1)FCM在临床医学中应用
淋巴细胞亚群分析、血小板分析、网织红细胞分析、白血病和淋巴瘤免疫分型、HLA-B27表型分析、PNH诊断、人类同种异体器官移植中的应用、艾滋病的诊断与治疗。
(2)FCM在基础研究中的应用
淋巴细胞功能、树突状细胞研究、造血干/祖细胞研究、细胞周期分析、细胞凋亡分析、总蛋白测定、细胞因子测定、细胞膜电位测定、胞内钙离子测定、细胞内pH测定、细胞内活性氧检测、蛋白质磷酸化检测、flow-FISH法测定端粒长度。
作为应用流式细胞术进行检测的技术平台,现代流式细胞仪产生于上世纪六七十年代。经过近四十年的发展和完善,今天的流式细胞仪已经十分成熟,并被广泛的运用于从基础研究到临床实践的各个方面,涵盖了细胞生物学、免疫学、血液学、肿瘤学、药理学、遗传学及临床检验等领域,在各学科中发挥着重要的作用。
一、流式细胞抗原染色方法
细胞表面抗原标记:细胞在各自正常分化成熟的不同阶段以及活化过程中,其细胞膜表面均可表达供鉴别的特殊结构,即表面标志。流式细胞术在细胞表面分子的检测与分析主要应用于免疫细胞及其亚群的检测与功能分析;血液系统细胞表面标志的研究;细胞群体及细胞表面标志变化的检测;细胞表面标志构成性质分析。
细胞内抗原标记细胞内或细胞核内染色结合流式细胞术分析确定某些细胞内细胞因子或蛋白表达水平。分析细胞内或细胞核内抗原的关键在于荧光标记的单克隆抗体能自由进入细胞内或细胞核内,且不能破坏细胞形态的完整性和保持细胞内靶抗原不变。因此细胞内或核内染色的关键在于细胞固定和胞膜或核膜穿透。
A、表面抗原直接标记
1、将消化下来的细胞用1 X PBS洗两遍,然后用0.5 mL 0.5%BSA的 1 X PBS重悬。
2、加入等量预热的4%多聚甲醛固定细胞,37℃,10分钟。(可选步骤)
3、用0.5%BSA的1 X PBS洗两遍。
4、3%BSA封闭。
5、样本标记:100μl 0.5%BSA的 1 X PBS内细胞量为0.5-1X106个
a)不标记细胞样本
b)同型对照
c)标记一抗
6、以抗体说明书上的比例加入抗体,冰上孵育30分钟。
7、用0.5%BSA的 1 X PBS洗两遍。
8、加入500 μl 1 X PBS上机检测。
B、表面抗原间接标记
1、将消化下来的细胞用1 X PBS洗两遍,然后用0.5 mL 0.5%BSA的 1 X PBS重悬。
2、加入等量预热的4%多聚甲醛固定细胞,37℃,10分钟。(可选步骤)
3、用0.5%BSA的 1 X PBS洗两遍。
4、样本标记:100μl 0.5%BSA的 1 X PBS内细胞量为0.5-1X106个。
a)不标记细胞样本
b)单独二抗
c)同型对照+二抗
d)一抗+二抗
5、以抗体说明书上的比例加入抗体,冰上孵育30分钟。
6、用0.5%BSA的 1 X PBS洗两遍。
7、0.5%BSA的 1 X PBS重悬细胞后加入等体积10%山羊血清,室温孵育15分钟。
8、加入荧光标记二抗,放置冰上,避光条件下孵育30分钟。
9、用0.5%BSA的1 X PBS洗两遍。
10、加入500μl 1 X PBS上机检测。
C、胞内抗体直接标记
1、将消化下来的细胞用1 X PBS洗两遍,然后用0.5 mL 0.5%BSA的 1 X PBS重悬。
2、加入等量37℃预热的4%多聚甲醛固定细胞,37℃孵育10分钟。
3、用0.5%BSA的 1 X PBS洗两遍并用1ml 90%的冰甲醇重悬细胞,放置冰上30分钟。
4、用0.5%BSA的 1 X PBS洗两遍。
5、3%BSA封闭。
6、样本标记:100μl 0.5%BSA的 1 X PBS内细胞量为0.5-1X106个。
a)不标记细胞样本
b)同型对照
c)一抗
7、以抗体说明书上的比例加入抗体,冰上孵育30分钟。
8、用0.5%BSA的 1 X PBS洗两遍。
9、加入500μl 1 X PBS上机检测。
D、胞内抗体间接标记
1、将消化下来的细胞用1 X PBS洗两遍,然后用0.5 mL 0.5%BSA的 1 X PBS重悬。
2、加入等量预热的4%多聚甲醛固定细胞,37℃孵育10分钟。
3、用0.5%BSA的 1 X PBS洗两遍并用1ml 90%的冰甲醇重悬细胞,放置冰上30分钟。
4、用0.5%BSA的 1 X PBS洗两遍。
5、样本标记:100μl 0.5%BSA的 1 X PBS内细胞量为5X105-1X106个。
a)不标记细胞样本
b)单独二抗
c)同型对照+二抗
d)一抗+二抗
6、以抗体说明书上的比例加入抗体,冰上孵育30分钟。
7、用0.5%BSA的 1 X PBS洗两遍。
8、0.5%BSA的 1 X PBS重悬细胞后加入等体积10%山羊血清,室温孵育15分钟。
9、加入荧光标记二抗,放置冰上,避光条件下孵育30分钟。
10、用0.5%BSA的1 X PBS洗两遍。
11、加入500μl 1 X PBS上机检测。
直接免疫荧光标记法 本方法操作简便,结果准确,易于分析,适用于同一细胞群多参数同时测定。虽然直标抗体试剂成本较高,但减少了间接标记法中较强的非特异荧光的干扰,因此更适用于临床标本的检测。
间接免疫荧光标记法 本方法费用较低,二抗应用广泛,多用于科研标本的检测。但由于二抗一般为多克隆抗体,特异性较差,非特异性荧光背景较强,易影响实验结果。所以标本制备时应加入阴性或阳性对照。另外,由于间标法步骤较多,增加了细胞的丢失,不适用测定细胞数较少的标本。
二、数据采集与分析
数据的显示通常可分为一维单参数直方图(histogramplot)、二维点图(dotplot)、二维等高图(contour)和假三维图(pseudo3D)等。最常用的是单参数直方图和二维点图。
1.单参数直方图
用来进行定性分析和定量分析。横坐标表示荧光信号或散射光信号强度的相对值,其单位用“道数”(channel)表示,横坐标可以是线性的,也可以是对数的。纵坐标通常代表细胞出现的频率或相对细胞数。
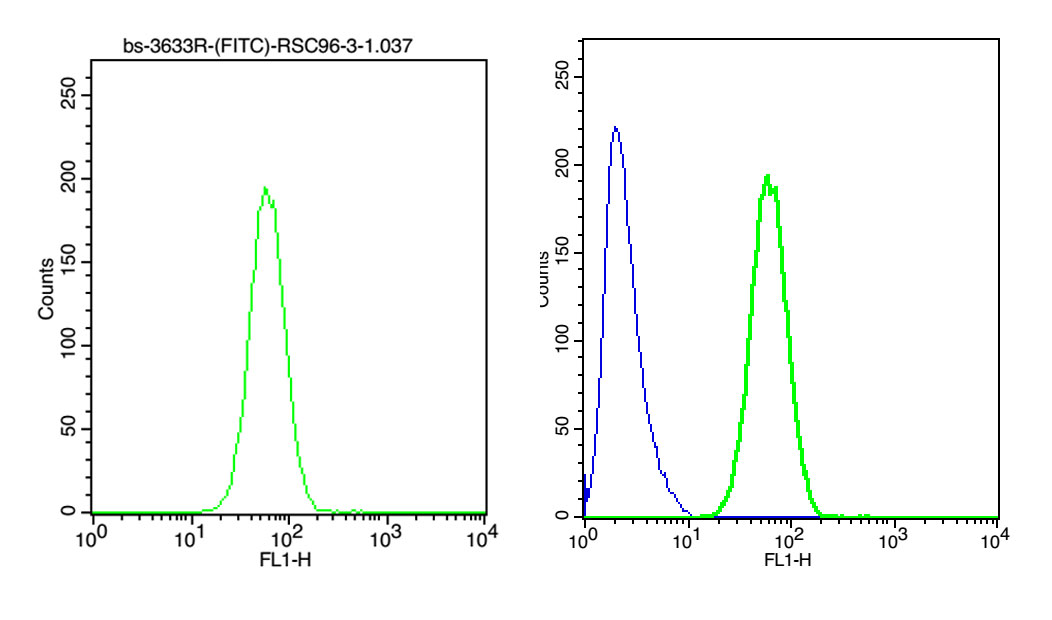
单参数直方图
2. 二维点图
当需要研究两个或更多测量参数之间的关系时,可采用二维点图。二维点图有两种形式,横坐标表示前向散射光(FSC),反映细胞的大小;纵坐标表示侧向散射光,反映细胞内颗粒的大小和多少。坐标图上每一点同时表示具有相应坐标值的细胞存在。
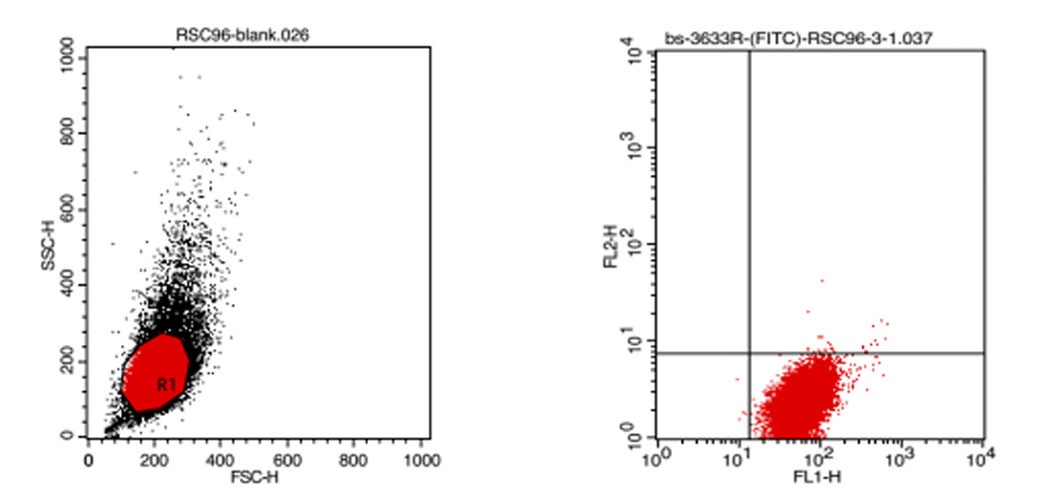
二维点囤的细胞群框定 荧光单染色二维点图
三、流式抗体选择标准
1. 满足抗体选择的基本条件
靶蛋白特异性:确定目的细胞的特异性表面标记或者胞内标记,知道您要检测什么。
种属:严格按照待测样本种属选择抗体来源,流式抗体基本无法进行种属间交叉反应。
应用领域:可用于流式实验,说明书中明确标注经FC实验测试,最好有实验数据图和用量说明。
抗体克隆号:一般选择参考文献上提到的克隆;同一抗体多个克隆号的情况下,可以选择荧光标记种类最多的那个克隆。
2. 确定流式细胞仪的参数配置
在设计流式方案前,先确定需要使用流式细胞仪检测的型号,对该仪器的参数配置要了解以下几个方面信息:
激光器:常见的流式细胞仪有488nm和635nm/633nm两个激光器,但有些机器在购买时因某些原因,只装了一个488nm激光器,所以需要注意型号相同的机器也未必激光配置相同。
滤光片:也就是有几个检测通道,这决定了你最多可以同时检测几个指标。
仪器的具体型号:有助于再次确定检测通道。因为同一个荧光在不同的流式细胞仪上检测,有时候检测通道也是不一样的。
3. 荧光的选择
选择直标还是间标:待测抗原表达高的尽量选择直标抗体,待测抗原表达丰度低的要考虑选间标生物素标记标抗体。
荧光强弱:荧光本身有强弱之分,可视抗原表达强弱及分群情况选择合适的荧光。如抗原表达弱或分群不明显的建议选择强荧光例如:PE、APC;反之,抗原表达强或分群明显的建议选择最常用的弱荧光例如FITC即可(常用荧光强弱排序程度为:PE>APC>PE-cy5/Cy5>PerCP/PerCP-Cy5.5/Cy5.5>FITC。
4. 多色荧光搭配的原则
多色分析方案中荧光抗体的选择和搭配,会受到很多因素的制约:
检测通道不能冲突:每个检测通道只能选择1种荧光素,各通道之间的荧光素可以随意搭配(如FL1选择了FITC标记的抗体,就不能再选择Alexa Fluor488标记的抗体;而同组实验的其余抗体选择PE或者APC标记,都是可以随意组合的);
荧光强弱:所选各种荧光素光谱的重叠应当尽量减少,否则将会导致较大的补偿。最常用的4色荧光搭配是:FITC、PE、PerCP/PerCP-Cy5.5、APC;
5. 同型对照抗体的选择
同型对照(Isotype Control),用于消除由于抗体非特异性结合到细胞表面而产生的背景染色,是真正意义上的流式阴性对照,流式细胞实验不可或缺的一项。同型对照是使用与一抗相同种属来源、相同亚型及亚链、相同荧光标记的免疫球蛋白,也要求使用相同剂量。
纯化级别抗体:如果是纯化的一抗加荧光标记的二抗,那么应该选择与一抗相对应的同型对照抗体(如样品管为:纯化的CD3+PE标记的二抗+样本;则对照管为:纯化的同型对照+ PE标记的二抗+样本)。
四、流式检测样品的制备
提示
1、流式细胞仪检测需要将细胞制备成单细胞悬液。
2、避免细胞成团,以免堵塞流式细胞仪。
3、实体组织制备单细胞悬液需要物理方法分离或酶消化法进行,具体组织的方法,依照经验来进行。
方案A: 培养细胞的制备
实验材料:0.25%胰,15ml或50ml的离心管。
实验流程:
1、如果是悬浮细胞,则小心将细胞移入离心管中,进行计数和活力分析。进行步骤3。
2、如果是贴壁细胞,建议使用0.25%的胰酶消化细胞,制备成单细胞悬液后置于离心管中计数和活力分析。
3、200g 离心5min。弃去上清,应用适量的流式孵育缓冲液重悬细胞,调整细胞浓度为1×107/ml。
方案B: 组织细胞制备。
实验材料与试剂:剪刀和镊子,载玻片, 60×15mm的组织培养皿;细胞过滤器(尼龙网过滤),0.01MPBS。
实验流程:
1、获取组织剪碎或切碎组织为2~4mm碎块,用1XPBS冲洗一遍,尽量多的去除组织内血块。
2、将剪碎的组织放在载玻片磨砂边,滴加两滴1XPBS, 另取一个磨砂边的载玻片进行研磨细胞至粘稠无颗粒物,过滤除去细胞碎片。
3、加PBS 5ml,200g离心5min,弃去上清。重复洗涤一次,计数和活力分析。
4、300g 离心5min,弃去上清,应用适量的流式孵育缓冲液重悬细胞,调整细胞浓度为1×107/ml。
五、常见问题与解答
1. 高荧光强度背景
(1)荧光标记的抗体浓度应该合适,如果浓度过高,背景会因为非特异性相互作用的增加而增加。
(2)在使用第一抗体之前,将样品与过量的蛋白一起培育,如小牛血清蛋白(BSA),脱脂干奶酪,或来自于同一寄主的正常血清作为标记的第二抗体。这个步骤通过阻断第一抗体和细胞表面或胞内结构的非特异性的交互作用来降低背景。
(3)在使用第一抗体之后,将样品与5%至10%的来自于同一寄主的正常血清和作为标记的第二抗体一起培育。这个步骤会减少不必要的第二抗体与第一抗体、细胞表面或胞内结构之间的交互作用。
2. 细胞染色阳性但很弱
(1) 抗细胞因子抗体浓度不对或者荧光染料选择不合适,增加抗体浓度,标本表面抗原表达量低,应该选择荧光强度高的荧光染料,如PE,APC等。 (2)通透后细胞在胞内染色前未洗, 按操作程序通透后洗细胞再胞内染色。(3)抗体与固定后的胞内抗原亲和力低,需提高抗体浓度。
3、严重的细胞损失
(1)洗涤离心步骤丢失细胞,固定后细胞密度低于活细胞,需用高转速离心,固定通透的细胞离心500g 。(2)加样步骤丢失细胞或弃上清带走细胞,应小心吸样。
六、注意事项
1. 标本处理:(1)全血实验 避免使用络合钙的抗凝剂,如ACD与EDTA,因为它们会限制钙依赖性激活过程,推荐用肝素钠。此外LPS,一种常见的生物试剂污染物,是强细胞激活剂,可能会混淆试验结果。血样在8小时内分析,超过8小时会导致活性的损失,一般细胞因子阳性细胞会减少5%。如不能在8小时之内检测,应将真空采血管水平室温放置。(2)组织样本制备 取组织时去除组织内凝固的血块。(3)固定,穿膜的试剂PH一定要正确。
2. 选择合适的对照:为保证结合的真实和可靠性,至少荧光设置同型对照:用于消除由于抗体非特异性结合到细胞表面而产生的背景染色;阴性对照(Isotype Control):非特异荧光的强弱取决于抗体浓度、单克隆荧光抗体特异性和纯度,应与试验管抗体相对应。在多色分析时,同型对照应与其它抗体同时使用,以避免补偿造成的误差。
3. 荧光素的选择:检测相对低表达细胞因子如IL-4时,应选用PE或APC标记;单检测某一细胞因子时最好也选用PE或APC标记;同时检测多种细胞因子时,弱表达的应选用PE或APC,FITC标记最好用于高表达细胞因子如IFN-γ。
4.采用直接与间接免疫荧光混合染色法时,原则上先进行间接标记,再进行直接标记。间接标记为细胞内染色时,应该考虑固定或透膜剂对直接标记抗体与靶目标的亲和力或靶目标的抗原性的变化等影响,若影响大,则应该先标记直接抗体。
流式检测所需溶液和试剂
1. 1X磷酸盐缓冲液(PBS):将8 g氯化钠(NaCl),0.2 g氯化钾(KCl),1.44 g磷酸氢二钠(Na2HPO4),0.24 g磷酸二氢钾(KH2PO4)溶解在800 ml蒸馏水(dH2O)中。用盐酸调节pH到7.4,定容至1升。室温保存。
2. 4%多聚甲醛溶液(无甲醇的): 100ml双蒸水中加入8g多聚甲醛然后在水浴锅中加热至50-60℃,加入几滴1mol/L的NaOH边加边搅拌直至全部溶解,溶解后置于冰水中冷却至室温,加入100ml的2倍的PBS。调节PH为7.4。
3. 孵育缓冲液:将0.5 g牛血清白蛋白(bovine serum albumin,BSA)溶解在100 ml的1 X PBS中。保存在4℃C。